Enlace Químico Iónico teoría
Enlace Químico Iónico
Enlace Químico Iónico (metal-no metal):
Se forma por transferencia total de electrones desde uno de ellos al otro, siendo un átomo metal y el otro no metal. Como los átomos son neutros, cuando un átomo cede un electrón, se queda cargado positivamente, formando lo que se llama un ion positivo o catión. La carga positiva de un catión monovalente es igual en magnitud; pero de signo contrario a la del electrón (1,602 · 10-19 C). Si un átomo capta un electrón, quedará cargado negativamente, formando así un ion negativo o anión. La carga negativa de un anión monovalente es, por tanto, la misma que la del electrón. Cuando se han formados dos iones de signo contrario, esto es, un catión y un anión, éstos se atraen mutuamente mediante fuerzas de tipo electrostático, y pueden formar de esta manera una molécula estable. Estas fuerzas electrostáticas de atracción, llamadas a veces fuerzas de Coulomb, son, por tanto, las responsables de la formación de los compuestos iónicos.
Supongamos el caso sencillo del cloruro sódico o sal común. El átomo de sodio (z=11) tiene un electrón solitario en el orbital 3s, un tanto aislado de las demás parejas; mientras que, en el átomo de cloro, existe también un electrón solitario, pero en este caso en el orbital 3pz, estando habitados los otros orbitales 3s, 3px y 3py, por sendas parejas de electrones.
bioprofe |enlace quimico ionico teoria|01
El electrón solitario del sodio pase al cloro, con lo que, además de formar una pareja con el electrón 3pz, se encontrará rodeado de otras parejas.
Los átomos de los metales alcalinos tienen todos ellos una configuración electrónica externa del tipo ns1, es decir, con un solo electrón en el orbital más externo. Este electrón, que se suele llamar electrón de valencia, está bastante alejado del núcleo, del que se halla separado, además por los otros electrones, llamados internos, que en gran parte apantallan la atracción del núcleo sobre dicho electrón de valencia. Por ello, es relativamente fácil arrancar este electrón, para lo cual se gastará poca energía. Esta es la energía de ionización, la cual, para los metales alcalinos, es muy pequeña.
Cuando a un átomo de un metal alcalino se le ha arrancado fácilmente el electrón de valencia, cuesta, sin embargo, mucho el arrancarle un segundo electrón, ya que su energía de ionización es muy elevada. Por esto, los metales alcalinos forman con relativa facilidad cationes monovalentes (M+).
En los átomos de los elementos del grupo 3 del Sistema Periódico (B, Al, Ga, In, Tl), cuesta ya bastante energía el arrancar los electrones de valencia que, en este caso, son del tipo ns2np1, por lo que es difícil que formen cationes trivalentes. Los más pesados forman en ciertos casos, cationes monovalentes.
Los elementos de los grupos 4, 5, 6 y 7 del Sistema Periódico, así como en los gases nobles, la energía de ionización es cada vez mayor, por lo que es muy difícil que estos elementos puedan formar iones positivos. Únicamente los elementos más pesados del grupo 4 (estaño y plomo) forman, en algunos casos, cationes divalentes (por pérdida de dos de los electrones de valencia np2). El resto de los elementos de estos grupos forman enlaces covalentes o bien iones negativos.
Los átomos de los elementos del grupo 7 del Sistema Periódico (halógenos) tienen una configuración electrónica externa ns2np5, esto es, les falta un solo electrón para completar los orbitales p y así la configuración electrónica del gas noble que les sigue en el mismo periodo. Por ello, es fácil comprender que, si a uno de estos átomos se les une un nuevo electrón, se obtendrá una configuración más estable, desprendiéndose energía en este proceso. Esta energía es la llamada afinidad electrónica, que para los halógenos es elevada. Estos elementos formarán, por tanto, con relativa facilidad aniones monovalentes (representados generalmente con el símbolo X–). Esos aniones no tienen ninguna tendencia a coger un segundo electrón, puesto que éste tendría que situarse, en solitario, en un orbital más externo, sin que el núcleo ejerciese sobre él ninguna fuerza de atracción. Los halógenos forman, por ello, sólo aniones monovalente.
A los átomos de los elementos de la familia del oxígeno (grupo 6 del Sistema Periódico) les faltan dos electrones para completar los orbitales externos np y adquirir la configuración de gas noble. Por esto, dichos elementos, tienen tendencia a formar iones divalentes, aunque en este proceso el balance energético es ligeramente negativo.
Los elementos de la familia del nitrógeno (grupo 5 del Sistema Periódico) forman muy difícilmente aniones trivalentes; mientras que los del grupo del carbono (grupo 4) es casi imposible la formación de aniones tetravalentes. Por ello, los compuestos de la familia del nitrógeno son en gran parte covalentes y los de la familia del carbono son típicamente covalentes.
Formación de compuestos iónicos:
Teniendo en cuenta la energía de ionización del sodio y la afinidad electrónica del cloro, se puede hacer el balance energético, según las ecuaciones:

bioprofe |enlace quimico ionico teoria|02
Lo que nos indica que en la formación de una pareja de iones Cl– y Na+, a partir de los respectivos átomos, en estado gaseoso, se gastan 1,34 eV. El balance energético todavía es más desfavorable si se parte, como se hace en el laboratorio, de sodio metálico y moléculas de cloro gaseoso, ya que, en este caso, hay que gastar, además, la energía necesaria para pasar los átomos de sodio desde el metal al estado gaseoso (calor de sublimación del sodio) y la energía de disociación, para romper en átomos libres las moléculas de cloro.
En los compuestos iónicos sólidos no existen moléculas, en el sentido ordinario de la palabra, sino que más bien todo el cristal puede considerarse como una molécula gigante, una macromolécula conteniendo millones de iones.
En los demás compuestos iónicos, las cosas suceden de manera análoga al caso del cloruro sódico. Cuando aniones y cationes no tienen las mismas cargas, como ocurre, por ejemplo, en el caso del fluoruro cálcico, formado por iones fluoruro, F–, e iones calcio, Ca2+, el número de iones negativos que rodean a cada ion positivo es el doble del número de iones positivos que rodean a cada ion negativo. De esta forma, en el cristal existe siempre doble número de aniones que de cationes, con lo que las cargas se compensan y resulta eléctricamente neutro. Por ello, estos compuestos iónicos se representan esquemáticamente por fórmulas del tipo F2Ca, aunque, como es natural, tampoco en estos casos puede hablarse de moléculas.
El ciclo de Born-Haber:
Este ciclo comprende la formación de un compuesto iónico desde la reacción de un metal (normalmente un elemento del grupo 1 o 2) con un no metal (como gases halógenos, oxígeno u otros) y se utiliza principalmente como medio para calcular la energía reticular, que no puede ser determinada experimentalmente.
La formación de iones gaseosos exige los siguientes procesos energéticos:
- un átomo de un metal necesita una cierta energía- energía de ionización, E para liberar uno o varios electrones.
- un átomo de un no metal cuando capta uno o varios electrones desprende energía -afinidad electrónica, Ae.
Podría pensarse que solo se formarían compuestos iónicos en el caso de que la energía liberada cuando el no metal capta electones, Ae, iguale o supere a la requerida para la ionización del metal, sin embargo esto solo sucede en muy contados casos.
Existen muchas sustancias iónicas – por ejemplo el cloruro de sodio- que son estables a pesar de que la energía de ionización del metal supera la electroafinidad del no metal. Todo esto hace sospechar que además de las dos clases de energía mencionadas existan otras que influyan también en la formación del compuesto.
La energía reticular representa teóricamente la formación de compuestos iónicos a partir de iones gaseosos. Algunos químicos la definen como la energía para romper los compuestos iónicos en iones gaseosos. La primera definición es exotérmica y la segunda endotérmica.
Con el ciclo de Born–Haber se calcula la energía reticular comparando la entalpía estándar de formación del compuesto iónico (según los elementos) con la entalpía necesaria para hacer iones gaseosos a partir de los elementos. Esta es una aplicación de la Ley de Hess.
Para hacer iones gaseosos de elementos es necesario convertirlos en gas, disociarlos si es necesario, e ionizarlos. Si el elemento es una molécula (por ejemplo F2), habrá que tener en cuenta su entalpía de disociación. La energía necesaria para arrancar un electrón y formar un catión es la energía de ionización, mientras que la necesaria para añadirlo y formar un anión es la afinidad electrónica.
La entalpía de formación se calcula sumando las entalpías de atomatización, ionización, sublimación, disociación, afinidad electrónica y su respectiva energía reticular.
FORMULARIO RESUMEN
Ciclo de Born-Haber:
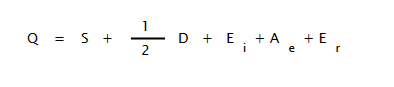
bioprofe |enlace quimico ionico teoria|03
Siendo:
Q: calor de formación del compuesto
S: calor de sublimación del metal
D: calor de disociación del no-metal
Ei: energía de ionización del metal
Ae: electroafinidad del no-metal
Er: energía de red del cristal
Puedes descargar la App BioProfe READER para practicar esta teoría de Enlace Químico Iónico con ejercicios auto-corregibles.
Enlace Químico Iónico




